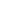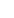2021年七一前夕,附屬瑞金醫院消化外科研究所于穎彥等在《Oncogene》在線發表了題為 “Dexamethasone suppresses immune evasion by inducing GR/STAT3 mediated downregulation of PD-L1 and IDO1 pathways”(地塞米松通過GR/STAT3下調PD-L1與IDO1雙通路從而抑制腫瘤免疫逃逸)的研究成果。
T細胞耗竭是腫瘤免疫逃逸的一個關鍵因素,亟待開發針對腫瘤的免疫治療新策略。本研究旨在針對T細胞耗竭尋找潛在化合物,以期提高對免疫檢查點抑制劑治療的反應性。研究首先對不同免疫逃逸能力腫瘤的基因轉錄組數據進行分析獲得差異表達基因,再通過藥物重定位CMap平臺對差異表達基因進行反向匹配分析,獲得具有提高免疫檢查點抑制劑反應性的潛在候選化合物。再通過基因集富集分析、LDH釋放、染色質免疫沉淀和免疫共沉淀等體外實驗探討分子機制。該研究借助了人源性類器官模型和人源化小鼠異種移植瘤模型,開展候選化合物的療效驗證研究。通過對25種具有調控腫瘤免疫逃逸潛能的候選化合物篩選發現,地塞米松在多種腫瘤的細胞系--T淋巴細胞共培養體系內均顯示出抗腫瘤效應。地塞米松可以同時降低PD-L1和IDO1兩個免疫檢查點的活性,從而抑制了T細胞免疫耗竭。地塞米松還可以增強3D類器官--T細胞共培養體系和人源化小鼠模型體內腫瘤細胞對免疫檢查點抑制劑的敏感性。分子機制探索顯示,地塞米松與糖皮質激素受體(GR)結合促進了GR的核轉位,并在細胞核內形成GR/STAT3復合物介導了PD-L1和IDO1雙靶點的轉錄抑制。
腫瘤的免疫治療是當前國內外研究熱點。然而,只有少數患者對免疫檢查點抑制劑治療有反應。靶向多重免疫檢查點可能是提高腫瘤對免疫檢查點抑制劑反應性的有效途徑,但首先需要探明多重免疫檢查點之間是否具有相關性,并分析它們協同作用的可能分子機制。本研究借助于數個公共數據庫開展了多種類型腫瘤的高通量數據分析,發現了PD-L1與IDO1雙靶點在多種腫瘤中的表達具有密切相關性。繼而又篩選到可能靶向雙靶點的25種候選化合物。實驗驗證顯示,在25種候選化合物中以地塞米松的作用最為明顯。地塞米松是臨床腫瘤治療中廣泛使用的支持性藥物,可以降低化療毒副作用,地塞米松的抗腫瘤作用正逐漸受到關注。鑒于地塞米松的雙刃劍作用,其用藥劑量尤為重要。本研究著重探索了不同劑量地塞米松對實驗結果的影響發現,低劑量地塞米松(體外實驗50nM,小鼠體內實驗0.1mg/kg)可以降低腫瘤細胞的PD-L1和IDO1表達,同時還可以降低微環境內T細胞的PD-L1表達,從而發揮抗腫瘤功效。但高劑量地塞米松(0.5mg/kg 或5mg/kg)可以促進腫瘤生長。
該項研究不僅利用了多種公共數據平臺,還采用了多種實驗手段與腫瘤研究模型,研究結果對今后指導腫瘤患者的免疫檢查點抑制劑治療具有重要參考作用。研究得到國家重點研發計劃、國家自然科學基金委員會、上海市科委、上海市轉化醫學協同創新中心、上海交通大學醫工交叉創新基金以及上海交大醫學院博士創新基金的支持。復旦大學附屬腫瘤醫院章真教授和美國俄克拉荷馬大學健康醫學中心的Min Li教授也參與了合作研究。
通訊作者:于穎彥 上海交通大學醫學院附屬瑞金醫院,主任醫師,教授,博士研究生導師,消化外科研究所副所長;研究方向:腫瘤分子病理學, 生物標志物及轉化醫學研究
第一作者:向臻,宋書錚 上海交通大學醫學院附屬瑞金醫院,普外科博士研究生;Zhijun Zhou美國俄克拉荷馬大學健康醫學中心博士后
轉載自|中國網





 全部商品分類
全部商品分類